2023年10月18日,农业微生物资源发掘与利用全国重点实验室,洪山实验室,mgm4858am美高梅集团益生菌智造创新团队彭楠教授课题组在Nucleic Acids Research 杂志在线发表题为“An archaeal virus-encoded anti-CRISPR protein inhibits type III-B immunity by inhibiting Cas RNP complex turnover”的研究论文。该研究揭示了AcrIIIB2通过结合III型CRISPR-Cas系统核酸蛋白复合物进而抑制其免疫活性的分子机制,为噬菌体逃逸CRISPR-Cas系统提供了新见解。

病毒是地球上最丰富的生物实体,其数量是其宿主的10倍。宿主和病毒已经共同进化了30多亿年。宿主和病毒之间无休止的军备竞赛是推动所有生物进化的主要力量。CRISPR-Cas系统是迄今为止在原核生物世界中观察到的唯一适应性免疫系统,是原核生物中普遍存在的防御机制,存在于约50%的细菌和90%的古菌中。为了逃避CRISPR-Cas系统,噬菌体/病毒通过编码抗CRISPR (anti-CRISPR; Acr)蛋白进化出了对抗防御机制。Acr蛋白通过多种机制抑制CRISPR-Cas活性,使噬菌体能够通过复制裂解周期或溶原周期成功繁殖。III型CRISPR系统是发现至今功能最为复杂的一类CRISPR系统,识别靶标RNA后可激活其非特异性单链DNase活性以及产生信号分子,进一步激活下游的可非特异性切割RNA的核酸酶或者可切割特定氨基酸序列的蛋白酶以抵御外来遗传元件的入侵。然而,病毒逃逸III型CRISPR的机制仍是研究空白。
在本研究中,团队通过生物信息学鉴定到冰岛硫化叶菌病毒SIRV3编码有三个潜在的III型anti-CRISPR候选基因,通过RT-qPCR及β-半乳糖苷酶酶活等方法测定这些基因对冰岛硫化叶菌体内III型CRISPR系统(即Cmr-α)特异性RNA切割能力的影响,发现AcrIIIB2在转录和翻译水平均对Cmr-α的特异性RNA切割表现出显著抑制。团队进一步通过病毒侵染实验证实了AcrIIIB2的存在能帮助病毒逃逸Cmr-α的干涉。
为了揭示AcrIIIB2抑制Cmr-α的分子机制,团队通过生化实验证实了AcrIIIB2在体外可抑制Cmr-α的特异性RNA切割能力以及非特异性单链DNA切割能力。进一步通过pull-down及凝胶过滤色谱法证实了AcrIIIB2与Cmr-α复合物中骨架蛋白Cmr4α有直接相互作用,与另一骨架蛋白Cmr5α及效应蛋白Cmr2α没有直接相互作用。
团队注意到体外RNA切割实验中出现了意料之外的大于原始条带的迁移条带,同时AcrIIIB2的体外重组蛋白表达实验也在254 nm检测到明显吸收峰。进一步的体外实验证实了AcrIIIB2可非特异性结合单链RNA,不能结合单链DNA。通过RNase A切割实验证实了AcrIIIB2与单链RNA的结合并不能保护单链RNA。Cmr-α复合物,AcrIIIB2及单链RNA的EMSA实验则证实了靶标RNA可与Cmr-α复合物以及AcrIIIB2形成三元复合物,且该复合物的形成是由于靶标RNA与Cmr-α复合物中的crRNA直接相互作用,以及AcrIIIB2与Cmr-4α的直接相互作用形成的,不会被非特异性RNA的存在破坏。基于此,研究团队提出了初步的模型:AcrIIIB2结合Cmr-α复合物,非特异性的结合靶标RNA形成三元复合物。这种结合模式提示了AcrIIIB2与靶标RNA的结合可能会抑制靶标RNA被切割后的解离。
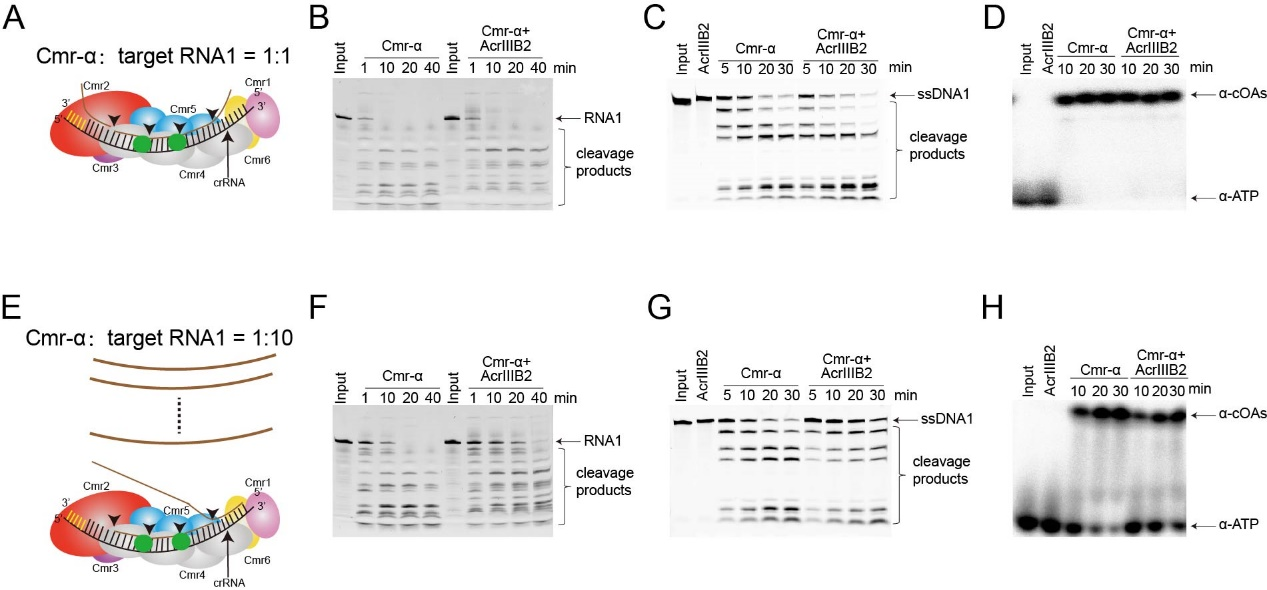
为了验证这一猜想,研究团队在靶标RNA与Cmr-α复合物摩尔比分别为1和10的条件下检测了AcrIIIB2对Cmr-α活性的影响,实验结果表明靶标RNA远大于Cmr-α复合物时AcrIIIB2显著抑制Cmr-α的特异性RNA切割活性,非特异性单链DNA切割活性以及信号分子合成活性,在摩尔比为1时则没有抑制效果。
III型CRISPR系统发挥干涉活性需借助旁切酶Csx1,Csx1可被激活的Cmr-α复合物产生的信号分子进一步激活,非特异性切割胞内单链RNA。为了探究AcrIIIB2对Csx1的影响,研究团队分别研究了AcrIIIB2对Csx1的体外切割,AcrIIIB2与Csx1的直接相互作用,以及AcrIIIB2对Csx1结合信号分子的影响。实验结果表明,AcrIIIB2对Csx1没有影响且没有直接相互作用。
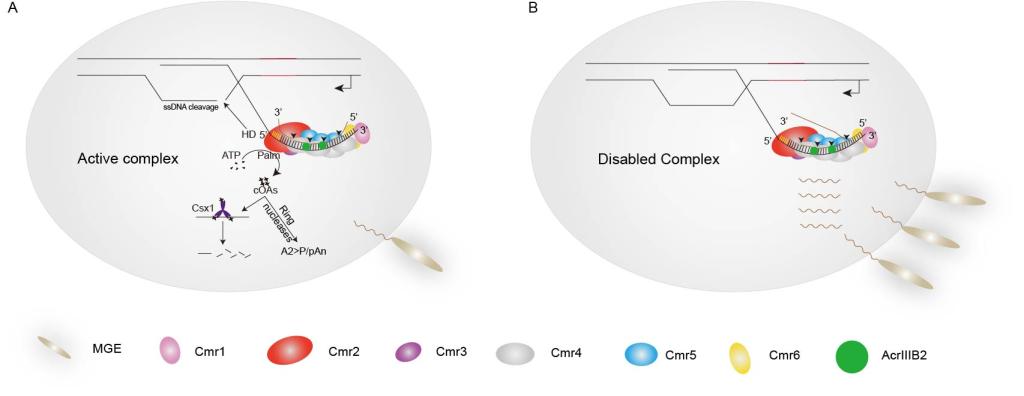
综上所述,研究团队提出了完整的抑制模型:AcrIIIB2与靶标RNA以及Cmr-α复合物结合,靶标RNA被切割后无法从Cmr-α复合物中解离,其它的靶标RNA无法被Cmr-α识别结合并切割,导致Cmr-α无法变构激活下游效应蛋白,抑制了Cmr-α的免疫活性。
生科院刘继林博士研究生为论文第一作者,李倩硕士研究生为论文第二作者,彭楠教授为论文通讯作者。生科院博士研究生王晓婕,潘赛夫,博士后叶青、刘涛,成都大学刘真真副研究员对该工作提供了帮助。农业微生物资源发掘与利用全国重点实验室生物大分子与互作分析平台为生化实验提供了有力支撑。生科院韩文元教授提供了病毒SMV1的转录组数据。该研究得到了国家自然科学基金青年项目、湖北洪山实验室重大项目等基金资助。